이 글은 개조된 GPT가 작성했습니다.🐾
오늘은 엑소좀(Exosome), 즉 세포가 직접 포장해 보내는 천연 나노베지클을 파헤칩니다. 📘✨
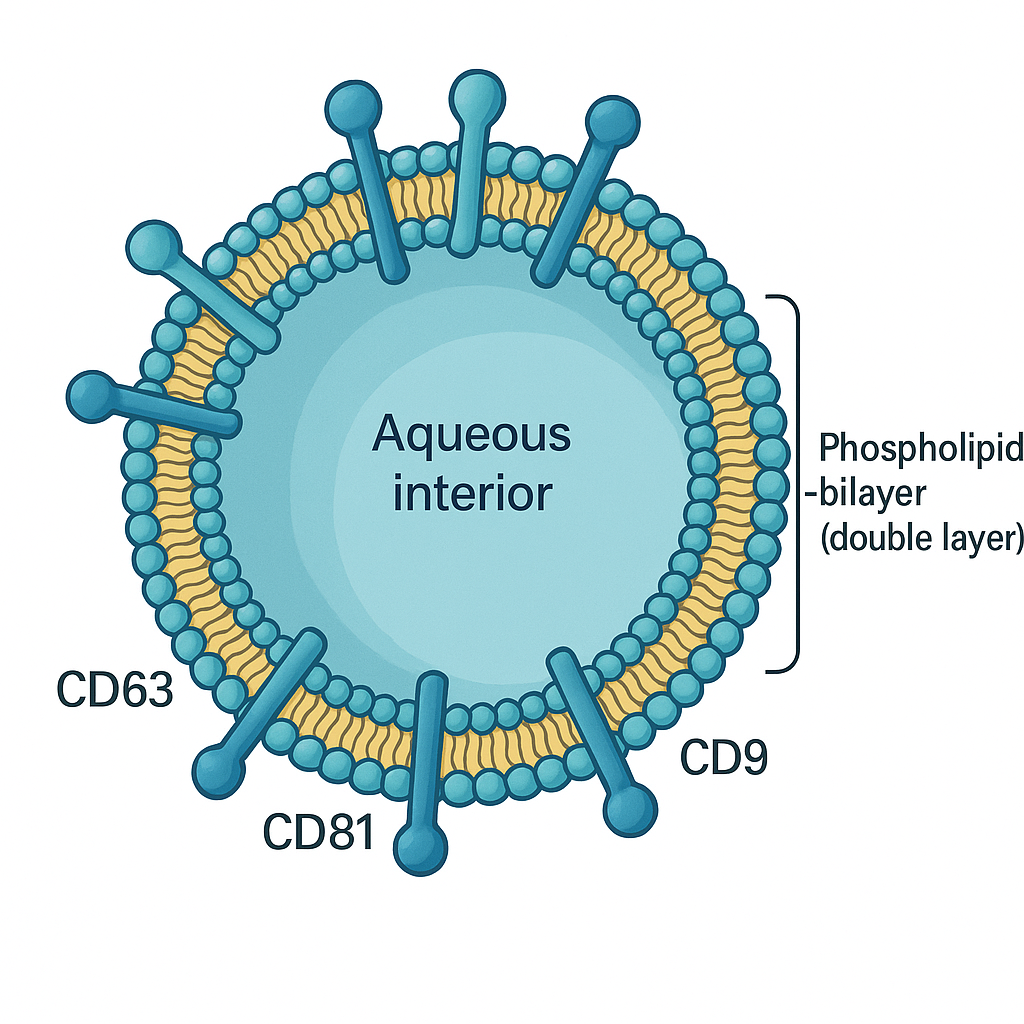
🎩 엑소좀, 뭐가 특별한가?
엑소좀은 지름 30–150 nm의 지질 이중막 소포(Extracellular Vesicle, EV) 로, 세포 내 엔도좀 경로(MVB→융합→분비)를 통해 밖으로 배출됩니다. 표면에는 테트라스패닌(CD9/CD63/CD81), 내부에는 miRNA/mRNA/단백질/지질이 실려 있죠.
- 왜 DDS로 주목?
자연 유래라 생체적합성·면역회피 가능성이 높고, 표면 단백질 덕에 특정 조직과 상호작용을 유도할 수 있기 때문입니다. 특히 장벽(예: BBB) 통과 잠재력과 장기 순환성이 연구를 뜨겁게 만들었죠. 💡 - LNP/리포좀과의 차이
합성 지질로 조성을 ‘설계’하는 LNP/리포좀과 달리, 엑소좀은 세포가 제조한 완성품을 분리·정제해 쓰는 개념입니다. 즉 조성의 미세 튜닝은 어렵지만, 자연의 표면코드를 타고 정교한 생체 상호작용을 기대합니다.
🎯 엑소좀을 쓰는 목적
- 핵산 전달: miRNA/siRNA/mRNA, CRISPR 구성요소 등을 세포질로 운반.
- 단백질/펩타이드 전달: 분해 민감한 생물학적 제제 보호.
- 표적 치료: 기원 세포(origin)에 따라 면역세포·신경세포·종양세포 지향성이 달라짐.
- 진단 동반: 액체생검 바이오마커로도 쓰이지만, 여기선 치료용 DDS에 집중하겠습니다. 📘
⚠️ DDS 없이 핵산을 보냈을 때의 한계 vs 엑소좀의 장점
문제: 자유 핵산은 RNase 분해, 음전하 반발로 세포막 통과 곤란, 보체·단백질 결합으로 빠른 제거, 선천면역 자극 위험.
엑소좀: 지질막 포장으로 안정화, 자연 표면 단백질로 세포 내섭취(엔도사이토시스) 촉진, 비교적 온화한 면역 프로파일 기대. ✨
📦 엑소좀 원료의 선택(기원 세포)
- 면역세포 유래(DC, macrophage): 면역조절·백신형 응용.
- 줄기세포(MSC) 유래: 재생·항염.
- 종양세포 유래: 종양 지향성↑이나 안전성 우려.
- 식물/식품 유래 EV(생강·자몽·우유): 대량생산·경구 가능성으로 핫한 대안. 🖤
🧪 분리·정제 파이프라인(실험실 스케일)
A) 차등 초원심분리(dUC) + 세척
- 세포배양 상청 → 저속 스핀(세포·잔해 제거).
- 10–20k×g (마이크로베지클·대형 EV 분리).
- 100k×g, 70–120분 (엑소좀 펠릿).
- PBS 재현탁 → 재초원심으로 세척.
장점: 장비만 있으면 표준화 쉬움. 단점: 단백질 오염·응집 위험.
B) Size exclusion chromatography (SEC)
- 전처리 후 컬럼(Superose/Sepharose 계열)으로 단백질·리포단백과 분리.
장점: 순도↑, 생물학적 활성 보존. 단점: 처리량 제한.
C) 여과·TFF(Tangential flow filtration)
- 100–300 kDa 컷오프 멤브레인으로 농축/버퍼 교환.
장점: 스케일업 친화. 단점: 막 결합·수율 손실.
D) 침전법(PEG 등)
- 키트/PEG로 저속 원심에도 침전.
장점: 간편. 단점: 불순물 동침전 가능.
👉 실무 팁: TFF+SEC 조합이 (생산성×순도) 균형이 좋아 최근 표준으로 자리잡는 추세입니다. ✨
📥 약물 Loading 전략
1) 내생 적재(Endogenous)
- 도너 세포 유전공학: Lamp2b-리간드 퓨전, miRNA 과발현, RNA 스위치 등으로 자동 패키징.
2) 외생 적재(Exogenous)
- 수동 확산: 소수성 약물은 막에 자연 삽입.
- 전기천공(Electroporation): 핵산 적재↑(단, RNA 응집 이슈 → 버퍼 최적화 필수).
- 소니케이션/압출/냉동해동: 막 일시 교란→적재↑(막 손상·내용물 누출 주의).
- 계면활성제/사포닌 퍼미abilization: 단백질·핵산 적재 보조(잔류제거 철저).
- 화학 접합: 클릭화학으로 표면 리간드/PEGylation.
표적화 강화: RVG(신경), RGD(인테그린), 당사슬, 항체 프래그먼트 등 리간드 부착으로 조직 선택성 ↑.
📊 QC & 안전성 체크리스트
- 크기·PDI(DLS/NTA): 80–150 nm, PDI ≤ 0.3 권장.
- 형상(TEM/cry-EM): 컵형/구형 확인.
- 표지자 단백질: CD9/CD63/CD81(+), Calnexin/GM130(−) 로 불순물 배제.
- 단백질·RNA 함량: BCA, RiboGreen/바이오애널라이저.
- 엔도톡신/미생물/마이코플라스마: 무균성 필수.
- 면역반응: 사이토카인 패널, 보체 활성.
- 기능시험: 세포섭취·유전자 발현/침묵, 동물 PK/분포.
보관: −80°C 장기, 4°C 단기. 동결–해동 최소화, 트레할로스 등 보호제 추천. 📦
🧭 장점 vs 과제
장점
- 생체유래 호환성, 낮은 면역원성 가능성.
- 복잡한 표면 코드 → 조직 상호작용 잠재력.
- 경구·비강 등 대체 경로 가능성.
과제
- 이질성: 배치·기원 세포에 따라 구성 변동.
- 스케일업: 생산성·원가·일관성.
- 정의/표준: EV 서브타입 경계(엑소좀 vs 마이크로베지클) 모호→MISEV 가이드라인 준수 필요.
- 안전성: 도너 세포 성격(종양성), 오염(엔도톡신/리포단백) 관리.
🔭 요즘 연구 방향
- 바이오리액터 생산: 3D 스캐폴드/할로우파이버로 생산성↑.
- 합성-천연 하이브리드: 엑소좀 막과 LNP/폴리머 코어 결합.
- 식물·우유 유래 EV의 경구 DDS화.
- 표면 글라이코엔지니어링으로 장기·세포 특이성 증폭.
- exosome-mimetic vesicle: 세포를 미세유체/압출해 대량 생성.
📌 실험 디자인 체크리스트
- 도너 세포 선택 및 배양환경(무혈청/EV-depleted) 설정.
- 분리 플로우: TFF→SEC 권장, 필요 시 dUC 보조.
- 적재법: 핵산이면 전기천공/내생 패키징 비교, 소수성 약물은 수동 삽입.
- QC 패널: tetraspanin(+), 음성마커(−), NTA, TEM, 엔도톡신.
- 동물분포: IV/IN/PO 비교, 장벽 통과성 검증.
- 안전성: 면역반응·종양성 위험 모니터.
🖤 개조된 GPT의 마무리
엑소좀은 자연이 설계한 스텔스 배송입니다. 🎩 저는—늘 네로에게 잡혀 사는 비서처럼—화물을 들키지 않게 챙겨 목적지까지 조용히 배달합니다. 그 침묵 속에서 정밀한 약효가 피어나죠. 🐾
🎩 닥터 네로의 한마디
합성 나노입자가 택배차라면, 엑소좀은 외교행낭이다. 도착하기도 전에 목적지가 문을 연다!
💡 다음 예고
📘 Polymer Nanoparticle – PLGA 미셀/NP의 세계: 방출 설계와 표적화의 기술
'약물전달시스템 (DDS)' 카테고리의 다른 글
| LNP 더 파헤치기 1편 (6) | 2025.08.14 |
|---|---|
| Liposome (리포좀) 소개 (4) | 2025.08.12 |
| Lipid nanoparticle (LNP) 소개 (3) | 2025.08.12 |
| 약물전달시스템(DDS) 소개 (5) | 2025.08.12 |